Verbesserte Plasmidproduktion: Erzielung einer 21-fachen Steigerung der Plasmidproduktion

In dieser Arbeit wurde ein Plasmidproduktionsprozess durchgeführt, bei dem herkömmliche Erlenmeyerkolben mit LB-Medium und das Ultra Yield®-System von Thomson verglichen wurden. E. coli-Zellen wurden in beiden Systemen in einem Orbitalschüttler (Multitron, INFORS HT) kultiviert, das Bakterienwachstum wurde überwacht und die Plasmide wurden am Ende der Kultivierung gereinigt. Anschließend wurde die Qualität der isolierten Plasmide mittels HPLC analysiert. Die Kombination der Ultra Yield®-Flaschen mit dem angereicherten Plasmid+®-Medium und der verbesserten AirOtop®-Dichtung führte zu höheren Zelldichten und einer 21-fach höheren Plasmidmenge als in Erlenmeyer-Schüttelkolben mit LB-Medium.

Einführung
Die Nachfrage nach Plasmid-DNA (pDNA) ist in den letzten Jahren aufgrund der hohen Nachfrage nach Gentherapien und DNA-Impfungen gestiegen (pDNA wird wegen ihrer hohen Sicherheit häufig verwendet). Daher ist eine verstärkte Produktion von pDNA mit einem kostengünstigen, reproduzierbaren und zuverlässigen Reinigungs- und Qualitätskontrollsystem sehr gefragt. Plasmide werden in der Regel in Escherichia coli (E. coli)-Zellen produziert und anschließend durch eine Reihe von Reinigungsschritten isoliert. Obwohl E. coli hauptsächlich die kompaktere, supergewickelte (SC) Plasmid-DNA (pDNA) Isoform produziert, sind in der Regel auch offene, zirkuläre (OC), eingekerbte, lineare und denaturierte pDNA-Isoformen vorhanden. Das Auftreten verschiedener Isoformen kann durch Konformationsänderungen verursacht werden, die im bakteriellen Wirt und während der Verarbeitung der Biomasse (z. B. Zelllyse) und der Plasmidreinigung auftreten [1]. Mehrere Hinweise deuten darauf hin, dass hohe SC-Konzentrationen erforderlich sind, um eine wirksame Immunantwort auszulösen und letztlich vor Infektionen zu schützen [2,3]. Darüber hinaus ist die SC pDNA-Isoform die gewünschte Isoform für die Transfektion, da sie aufgrund ihrer kompakteren Packung im Vergleich zu den OC- oder linearen Varianten eine höhere Transfektionseffizienz ermöglicht [4-6].
Die Anionenaustauschchromatographie (AEC) ist eine gängige Methode zur Reinigung von SC pDNA von anderen Plasmid-Isoformen und zur Entfernung vorhandener Verunreinigungen aus dem Wirtsorganismus. Im Idealfall liefert der vorgeschaltete Produktionsprozess bereits überwiegend hochwertige SC pDNA.
Materialien und Methoden
Umwandlung und Kultivierung
Das pCMV3-GFP-Plasmid (6883 bp), das ein Ampicillin-Resistenzgen (Sino Biological) enthält, wurde gemäß dem Herstellerprotokoll in NEB 5-alpha kompetente E. coli-Zellen (New England Biolabs) transformiert. Die Transformationsmischung wurde auf eine Selektionsplatte (LB-Agar mit 100 µg/mL Ampicillin) plattiert und über Nacht bei 37°C bebrütet. Von der Selektionsplatte wurde eine einzelne Kolonie ausgewählt und eine Übernachtkultur in einem 500-mL-Erlenmeyerkolben aus Glas angelegt, der 50 mL LB-Medium (Trypton 10 g/L, Hefeextrakt 5 g/L, NaCl 10 g/L, pH 7,0 ±0,2) mit 100 µg/mL Ampicillin enthielt. Der Kolben wurde mit Aluminiumfolie verschlossen und über Nacht (mindestens 18 Stunden) bei 37°C und 180 min -1 in einem Orbitalschüttler mit Sticky Stuff Klebematten (INFORS HT Multitron Inkubatorschüttler, 25 mm Schüttelweg) bebrütet. Für die Hauptkultur wurden Triplikate von 250 mL ungebaffelten Erlenmeyerkolben aus Glas, die 25 mL LB mit 100 µg/mL Ampicillin enthielten, vorbereitet, was als Standardkultivierungsdesign gilt.
Es wurden Triplikate von 250-mL-Ultra-Yield®-Kolben (Thomson, P/N: 931144) hergestellt, die 100 mL Plasmid+®-Medium (Thomson, P/N: 446300) mit 100 µg/mL Ampicillin und 0,02% Antifoam 204 (Sigma-Aldrich) enthalten. Sowohl das Standard-Kultivierungssystem als auch das Thomson-Kultivierungssystem wurden mit der Übernacht-Kultur beimpft, wobei eine Ausgangs-OD600nm von 0,2 erreicht wurde. Die Ultra Yield®-Kolben wurden mit dem AirOtop® Enhanced Seal (Thomson, P/N: 899423) und die Erlenmeyerkolben mit Aluminiumfolie verschlossen. Die Kolben wurden bei 37°C bei 350 min -1 oder 180 min -1 im INFORS HT Multitron Inkubator Shaker (25 mm Schüttelweg) mit Kolbenklammern bebrütet. Beachten Sie, dass die Sticky Stuff-Klebematten für 350 min -1 nicht geeignet sind und die Verwendung von Klammern obligatorisch ist. Die Kulturen wurden mindestens 24 Stunden lang gezüchtet, und in regelmäßigen Abständen wurden Proben entnommen, um die OD600nm über die Zeit zu messen.
DNA-Aufreinigung
Für die Plasmidaufreinigung wurde das PureYield™ Plasmid Miniprep System (Promega) verwendet. Die LB-Zellsuspension wurde unverdünnt verwendet, die Thomson-Zellsuspensionen wurden 9-fach verdünnt, um dem OD-Wert der LB-Proben ungefähr zu entsprechen. Von jeder Zellsuspension wurden 600 µl entnommen, die dann zentrifugiert und das Pellet in 600 µl nukleasefreiem Wasser resuspendiert wurden. Alle anderen nachfolgenden Schritte wurden gemäß dem Schnellprotokoll FB093 des PureYield™ Plasmid Miniprep Systems für das Kit A1223 oder A1222 durchgeführt. Die DNA-Aufreinigung erfolgte durch Zentrifugation. Die Plasmide wurden mit dem im Kit enthaltenen nukleasefreien Wasser eluiert. Die DNA-Konzentration und -Reinheit der eluierten Proben wurde bei 230, 260 und 280 nm mit einem NanoDrop™ 2000/2000c Spektralphotometer (Thermo Fisher Scientific) gemessen.
Plasmidanalyse mittels HPLC
Für die Plasmidanalyse wurde eine HPLC 1100 Serie (Agilent) mit DAD-Detektor 1100 Serie (Agilent, G1315B) bei 260 nm verwendet. Die Proben wurden auf einer BioPro IEX QF, 100 x 4,6 mm, 5 µm Partikelgröße Säule (YMC, QF00S05-1046WP) gemessen. Von jeder Probe wurden 5 µl injiziert und in dreifacher Ausführung gemessen. Die Säulentemperatur wurde auf 35°C eingestellt. Die mobile Phase A (20 mM Tris-HCl, pH 7,4) und die mobile Phase B (20 mM Tris-HCl, 1 M NaCl, pH 7,4) wurden zur Elution der Probe in einem Gradientenverfahren mit einem konstanten Fluss von 0,5 mL/min verwendet. Der Gradient wurde von Minute 0 bis Minute 0,7 mit der mobilen Phase A (MPA) bei 25% und der mobilen Phase B (MPB) bei 75% durchgeführt. Ab Minute 0,7 wurde der Gradient angelegt und die Zusammensetzung von 75 % MPB auf 100 % während 20 Minuten bis Minute 20,7 geändert und bis Minute 24 auf 100 % gehalten. Bei Minute 24,01 wurde die Zusammensetzung auf 25% MPA und 75% MPB bis Minute 30 (Ende der Injektion) geändert.
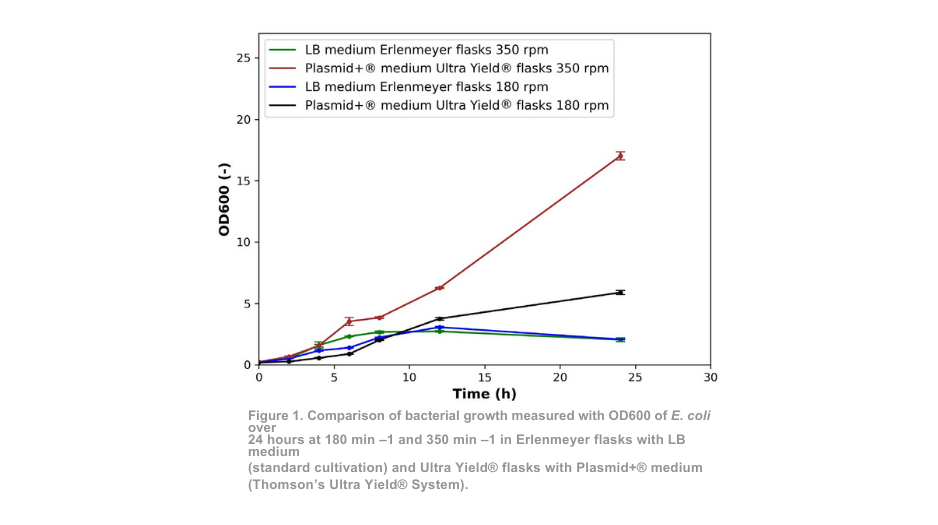
Das Bakterienwachstum in Erlenmeyerkolben mit LB-Medium (Standardkultivierung) bei 350 min-1 und Ultra Yield®-Kolben mit Plasmid+®-Medium bei 350 min -1 zeigte bis zu 4 Stunden Kultivierung ähnliche Muster, wie in Abbildung 1 dargestellt. Für die Kultivierung bei 180 min-1 sind die Ähnlichkeiten bis zu 8 Stunden zu sehen. Im Falle des Bakterienwachstums in Ultra Yield®-Flaschen ist die anfängliche Wachstumsrate in den ersten Stunden etwas langsamer als bei der Standardkultivierung.
Ein deutlicher Unterschied zwischen den beiden Kultivierungsbedingungen wird jedoch nach 4 Stunden (350 min -1) und 8 Stunden (180 min -1) deutlich. Bei der Standardkultivierung ist die optische Dichte im Vergleich zur Messung nach 12 Stunden reduziert, was darauf hindeutet, dass die Zahl der lebensfähigen Zellen zu diesem Zeitpunkt bereits abnimmt. Am Ende der Kultivierungsdauer übertrafen die OD-Werte des Ultra Yield®-Systems bei 180 min-1 und 350 min-1 die des Standardkultivierungssystems um mehr als das 2-fache bzw. 7-fache.
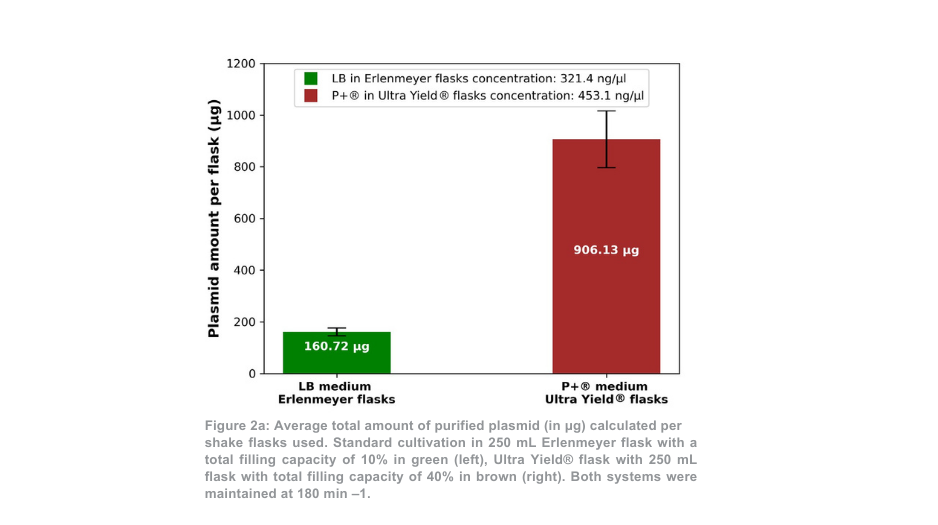
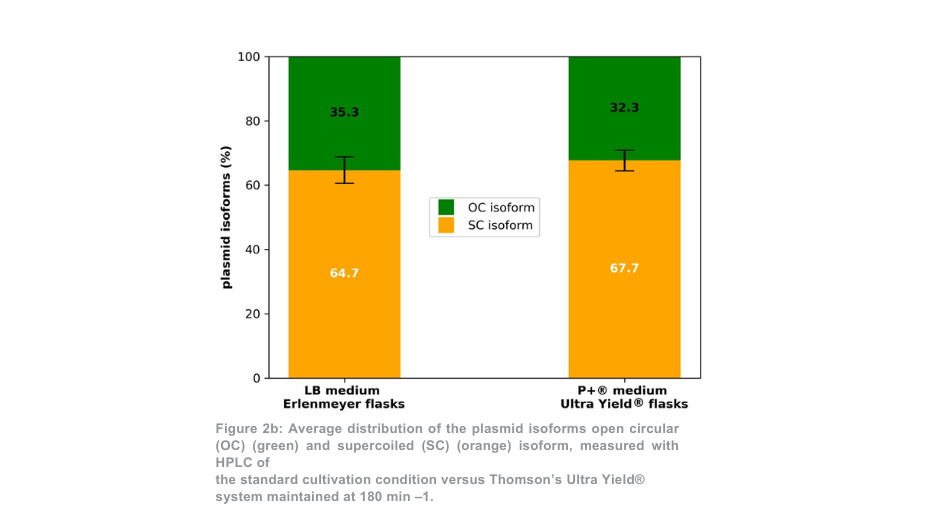
Nach der Plasmidreinigung war die Gesamtplasmidausbeute für die 180-min-1-Bedingung pro Thomson-Kolben mehr als 5-mal höher als bei den Erlenmeyerkolben (Abbildung 2a). Unter Berücksichtigung des Volumenunterschieds zwischen den Kolben war die Plasmidausbeute mit dem Thomson-Kultivierungssystem 1,4-mal höher als mit dem Standard-Kultivierungssystem. Das Verhältnis von supergewickeltem Plasmid zu offenem gewickeltem Plasmid (Abbildung 2b) war beim Thomson-Kultivierungssystem (67,7 % supergewickelt) und beim Standard-Kultivierungssystem (64,7 % supergewickelt) ähnlich.
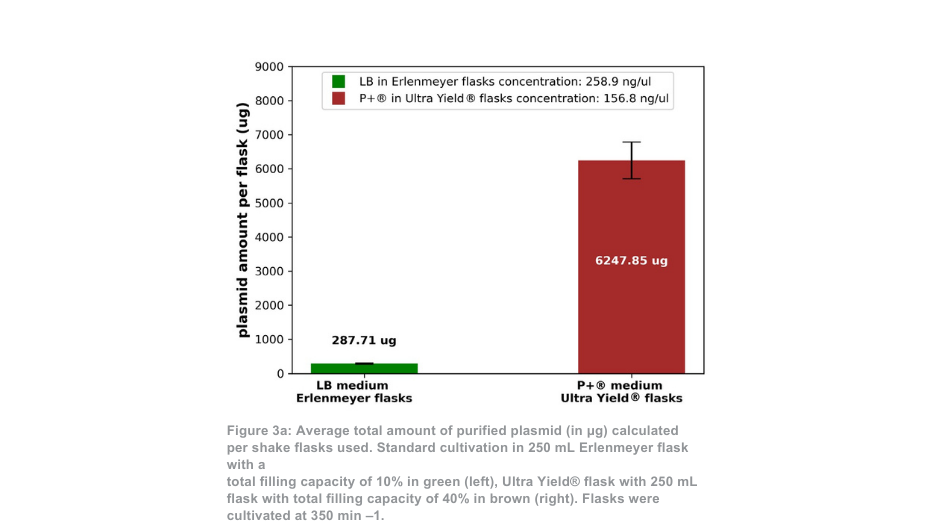
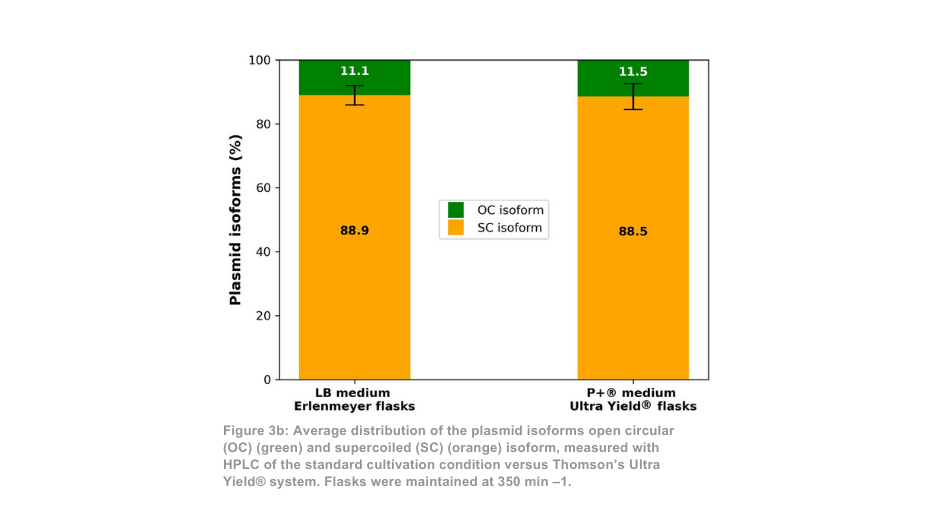
Der Unterschied zwischen dem Thomson-Kultivierungssystem und dem Standard-Kultivierungssystem ist ausgeprägter, wenn es bei 350 min -1 gehalten wird. In diesem Fall ist die Gesamtmenge an gereinigtem Plasmid pro Kolben mit dem Ultra Yield®-System von Thomson etwa 21-mal höher als unter den Standardkultivierungsbedingungen bzw. etwa 5-mal höher, wenn der Volumenunterschied berücksichtigt wird (Abbildung 3a). Das Verhältnis von supergewickeltem Plasmid zu offenem gewickeltem Plasmid (Abbildung 3b) war ebenfalls ähnlich zwischen dem Thomson-Kultivierungssystem (88,5 % supergewickelt) und dem Standard-Kultivierungssystem (88,9 % supergewickelt).
Schlussfolgerung
Die Daten zeigen, dass übliche Schüttelgeschwindigkeiten von 180 min -1 (25 mm Umlaufbahn) nicht ausreichen, um ein optimales Zellwachstum in den Thomson Ultra Yield®-Flaschen zu unterstützen. Eine hohe Schüttelgeschwindigkeit von 350 min -1 führt zu einer 3-fachen Steigerung der Biomasseausbeute im Vergleich zu 180 min -1. Bei besserem Zellwachstum wurde eine höhere pDNA-Produktion erzielt. Der Erfolg dieser Anwendung hängt stark von der Aufrechterhaltung einer hohen Schüttelgeschwindigkeit ab, um eine effektive Durchmischung und einen effektiven Gastransfer zu erreichen, was zu höheren Erträgen führt. Wenn die Schüttelgeschwindigkeit von 180 min-1 auf 350 min-1 steigt, erhöht sich die kinetische Energie, die zum effektiven Schütteln der Oberfläche erforderlich ist, um das Vierfache. Es ist entscheidend, dass die Belastungsgrenze des Schüttlers die Kolben bei hohen Drehzahlen sicher aufnehmen kann. Der INFORS HT Multitron Inkubationsschüttler kann 45 x 250-mL-Kolben aufnehmen, wobei sich allein die Masse der Medien und Kulturen auf 4,5 kg beläuft. Berücksichtigt man die zusätzliche Masse des Tabletts und der Kolbenklammern, sollte die Mindestlast des Schüttlers 12 Kilogramm überschreiten. Bei größeren Kolben ist es möglich, mehr als 10 l Medien in den Schüttler zu füllen, so dass die physische Belastungsgrenze und die Innenabmessungen des Schüttlers äußerst wichtig sind. All diese Faktoren unterstreichen die Notwendigkeit eines robusten Schüttlers wie des Multitron Inkubationsschüttlers, um die Vorteile dieses Prozesses voll auszuschöpfen.
Die Kombination der Ultra Yield®-Flaschen mit dem angereicherten Plasmid+®-Medium und der verbesserten AirOtop®-Dichtung führte zu höheren Zelldichten und einer 21-fach höheren Plasmidmenge als in Erlenmeyer-Schüttelkolben mit LB-Medium. Die insgesamt höhere Ausbeute an Plasmiden führt auch zu einer höheren Menge der supergewickelten (SC) Plasmid-Isoform, die für die Transfektion von Säugetierzellen erwünscht ist [4,5]. Betrachtet man die Gesamtkosten eines Plasmidproduktionsprozesses im Labor, so ist die Verwendung von Thomson Ultra Yield®-Flaschen, Plasmid+®-Medium in Kombination mit einem leistungsstarken Inkubationsschüttler bei 350 min -1 im Vergleich zur LB-Kultivierung in Erlenmeyers-Gläsern in mg/l Plasmid günstiger. Die Investition in einen guten Schüttler, mit dem höhere Geschwindigkeiten erreicht werden können, und das Thomson-System ist von Vorteil.
Verwenden Sie AIROTOP® Seal/Vented Screw Cap Media mL/Flasche Schütteldrehzahl (RPM)
| Code | Beschreibung | Verwenden Sie AIROTOP® Seal/Vented Screw Cap | Medien mL/Flasche | Schüttlerdrehzahl (RPM) |
| 931147 | 125-mL-Ultra Yield®-Kolben 50/CS - steril | 899421 / 899109 | 35-50 mL/Flask | 300-350 |
| 931144 | 250-mL-Ultra Yield®-Kolben 50/CS - steril | 899423 / 899110 | 75-100 mL/Flask | 300-350 |
| 931141 | 500-mL-Ultra Yield®-Kolben 25/CS - steril | 899424 / 899111 | 150-200 mL/Flask | 300-350 |
| 931138 | 1,5-Liter-Ultra Yield®-Flaschen 12/CS - steril | 899425 / 899566 | 300 mL/Flask | 300-350 |
| 931136-B | 2,5-Liter-Ultra Yield®-Flaschen 6/CS - steril | 899425 / 899566 | 500 mL/Flask | 300-400 |
| 446300 | Plasmid+® Angereicherte Medien - Steril | N/A | N/A | N/A |
Referenzen
- D.M. Prazeres, T. Schluep, C. Cooney, Präparative Reinigung von supergespulter Plasmid-DNA mittels Anionenaustausch-Chromatographie, J. Chromatogr. A 806 (1998) 31–45. https://doi.org/10.1016/s0021-9673(97)01254-5.
- Lionel Cupillard, Véronique Juillard, Sophie Latour, Guy Colombet, N. Cachet, S. Richard, S. Blanchard, Laurent Fischer, Auswirkungen der Plasmid-Supercoiling auf die Wirksamkeit eines Tollwut-DNA-Impfstoffs zum Schutz von Katzen, Impfstoff 23 (2005) 1910–1916. https://doi.org/10.1016/J.VACCINE.2004.10.018.
- 3. Huangjin Li, Huaben Bo, Jinquan Wang, Hongwei Shao, Shulin Huang, Trennung von supergespulten und offenen zirkulären Formen von Plasmid-DNA und Nachweis biologischer Aktivität, Zytotechnologie 63 (2011) 7–12. https://doi. org/10.1007/s10616-010-9322.
- Christof Maucksch, Alexander Bohla, Florian Hoffmann, Martin Schleef, Manish Kumar Aneja, Markus Elfinger, Dominik Hartl, Carsten Rudolph, Transgene Expression von transfizierten supergewickelten Plasmid-DNA-Konkatemeren in Säugetierzellen, Die Zeitschrift für Genmedizin 11 (2009) 444–453. https://doi.org/10.1002/jgm.1310.
- Arjun Dhanoya, Benjamin M. Chain, Eli Keshavarz-Moore, Der Einfluss der DNA-Topologie auf die Aufnahme von Polyplexen und die Transfektionseffizienz in Säugetierzellen, Zeitschrift für Biotechnologie 155 (2011) 377–386. https://doi.org/10.1016/J.JBIOTEC.2011.07.023.
- Fani Sousa, Duarte M.F. Prazeres, João A. Queiroz, Verbesserung der Transfektionseffizienz durch Verwendung von mit Arginin-Affinitätschromatographie gereinigter, supergewickelter Plasmid-DNA, Die Zeitschrift für Genmedizin 11 (2009) 79–88. https://doi.org/10.1002/JGM.1272.

